En WWI PROCAT, Ingeniería española especializada en protección catódica sabemos que la corrosión es la tendencia que tienen los metales a volver al estado combinado, es decir, al mismo estado en que se encontraban en la naturaleza, que es, en términos termodinámicos, el estado más estable. En el caso del acero o del hierro la corrosión se pone de manifiesto con la conocida "herrumbre".
Si exceptuamos la corrosión a temperaturas elevadas, que es un proceso puramente químico, los restantes procesos de corrosión son siempre de naturaleza electroquímica, tratándose de la formación de una pila, con una corriente eléctrica que circula entre determinadas zonas de la superficie del metal, conocidas con el nombre de ánodos y cátodos, y a través de una solución llamada electrólito capaz de conducir dicha corriente. El funcionamiento de estas pilas da lugar a la corrosión de las zonas anódicas.
El origen de las pilas de corrosión tiene lugar por el contacto de diferentes metales (par galvánico), diferencias en la estructura o propiedades de un mismo metal, o por diferencias en el electrólito, bien en sus características físicas como químicas (que afectan a las electroquímicas).
Una causa frecuente de corrosión son las corrientes vagabundas (especialmente las de corriente continua). Se trata de corrientes que circulan por el suelo, derivadas por ejemplo de la vía de los ferrocarriles electrificados, y que antes de volver a su circuito de origen se conducen por medio de un buen conductor, como por ejemplo una tubería de acero. Las zonas de entrada de corriente son catódicas mientras que las de salida son anódicas y por lo tanto se corroen. La velocidad de corrosión depende de la densidad de corriente anódica, disolviéndose el acero a razón de 9,1 Kg por cada amperio y año (ley de Faraday).
Cuando los átomos del ánodo se disuelven para formar los iones, los electrones que se liberan hacen el ánodo negativo con respecto a la solución (realmente lo que se polariza negativamente es la capa de difusión entre el ánodo y el electrólito). Los electrones pasan al cátodo a través de la masa metálica y neutralizan los iones positivos. Por consiguiente, la corrosión es causada por los procesos simultáneos anódicos y catódicos.
Naturalmente la transmisión de corriente, en las pilas de corrosión, es de corriente continua (electrones en las partes metálicas del conductor y iones en el electrólito).
Hoy día, cada vez más, se está empezando a considerar la corrosión por corriente alterna, debida a corrientes vagabundas de alterna, o bien a corrientes de inducción, causadas por el paralelismo de conducciones de acero enterradas, con un buen revestimiento (aislamiento) con líneas eléctricas de alta tensión. Este problema antes no se tenía en consideración debido a que la corriente alterna tiene un poder de corrosión muy pequeño si se compara con la corriente continua, pero el aumento en la calida y el aislamiento de los revestimientos modernos (especialmente los epoxi en polvo con polietileno extruido) hace que los contactos de las tuberías con tierra (defectos del revestimiento) sean menores en cantidad y normalmente también en tamaño, con lo que la resistencia entre tubería y suelo es mayor y por lo tanto también el voltaje de las corrientes inducidas, provocando que en los pequeños defectos del revestimiento tengan lugar salidas de corriente alterna de gran densidad de corriente (relación corriente/superficie), y por tanto pudiendo causar daños por corrosión serios en las tuberías.
Este problema de corrosión por alterna se está estudiando mucho en Europa, y las soluciones y que se están adoptando tienden a dar una gran seguridad en el aspecto de protección contra la corrosión y del personal que manipula las tuberías (por las posibles sobretensiones tanto de alterna como de continua).
GALERIA DE FOTOS 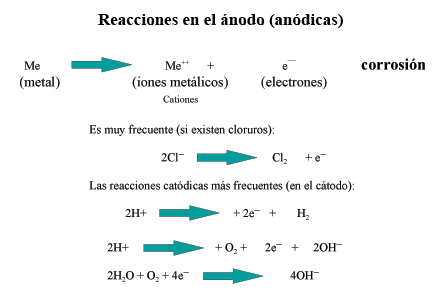

|
Todos los derechos reservado. Aviso legal


